
Turistika za editací genomů? Jednou pravděpodobně vypukne, říká Helena Fulková
06. 01. 2022
Jako jedna z mála na světě naklonovala myš. Nedávno se jí podařilo geneticky upravit křečka a vyzkoumat díky němu možné příčiny neplodnosti. Editace genomů u zvířat je podle Heleny Fulkové z Ústavu experimentální medicíny AV ČR opodstatněná. U lidí se ale pojí s řadou etických problémů, podobně jako klonování. „Je hrozně nepravděpodobné, že by ke klonování lidí vůbec došlo,“ tvrdí v rozhovoru v časopisu A / Věda a výzkum.
Úspěchy s klonováním a genetickými modifikacemi vás vynesly mezi elitní světovou skupinu vědců. Je k vaší práci – vedle nutných vědomostí a nabytých zkušeností – potřebný také nějaký specifický talent?
Určitě. Jde hlavně o koordinaci během mikromanipulací, kdy pracuji na velmi malém prostoru, ale musím mít v pohybu celé tělo. V jedné chvíli šlapu na pedál, nohou přepínám a spouštím pulzy. Rukama ovládám manipulátory a injektory, a ještě se musím dívat, co dělám.
Jak dlouho v takové pozici vydržíte?
Asi tak dvě hodiny v kuse. Víc se většinou soustředit nevydržím. Velmi mě baví a je pro mě uspokojující, když se dostanu do flow stavu a vytěsním vše ostatní. Kromě schopnosti koordinace a soustředění je ale u mé práce ještě důležitá tvrdohlavost. Je potřeba nevzdávat se, když to prostě nejde.
Tvrdohlavost se vám pravděpodobně bude ještě hodit. Aktuálně chcete otevřít nový směr bádání výzkumu buněk. Co vás k tomu vede?
Mojí motivací je pochopit, jak buňky fungují. Proto se teď chci zaměřit na principy, které stojí za fungováním lidského těla. Už mě nebaví rozebírat systém na jednotlivé geny, protože buňky jsou přece komplexní, stejně jako život. Jsou flexibilní, je to dynamický systém. I když něco objevíte, stejně víte, že za jiných podmínek by to mohlo být jinak. Buňky nebo embrya si vždycky najdou cestu vedle. Příkladem jsou třeba rakovinové buňky. V živém systému není nic stoprocentní.
Kdy a proč vás přestal bavit klasický přístup?
Během mé kariéry se už několikrát stalo, že vědci přišli s něčím úžasným. Jenže později se ukázalo, že zase o takový hit nešlo. Třeba když se podařilo sekvenovat lidský genom. Všichni říkali: Už víme, jak vše funguje, najdeme všechny mutace, všechno vyléčíme. Budoucnost byla růžová. Jenže se nenaplnila. Pak nastoupily technologie profilování genové exprese. A zase všichni říkali: Zjistíme naprosto přesně, co buňky exprimují za geny, jaké mají proteiny. A zase se to úplně nestalo. Rozhodně se nechci dotknout výzkumů mých kolegů, ale podle mého názoru jednotlivé geny řeknou o fungování celku strašně málo.
Trendem ve vědě je interdisciplinární spolupráce. Plánujete přizvat k výzkumu vědce z jiného oboru?
Ano, snažím se dát dohromady s biofyziky, abychom se mohli podívat na obecnější jevy. Zatím hledáme společnou řeč. A to vůbec není jednoduché. Vlastně je hodně těžké zbavit se toho, co mě doteď ve škole i zkušenější kolegové naučili.
Alternativní cestou jste se vydala také při výzkumu role enzymu acrosinu při oplodnění. Proč jste si vybrala nezvyklý výzkumný model křečka?
Role acrosinu při průniku spermie do vajíčka byla dlouho otázkou. Ukázalo se, že u myší zrovna nehraje žádnou roli. Ty jsou sice stále experimentálním modelem číslo jedna, ale v tomto případě bylo potřeba sáhnout po alternativě. A tou byl křeček, mimochodem v historii byl velmi využívaným modelem. Postupně ale všichni přešli na myš a křeček upadl v zapomnění. Většina lidí, kteří s ním pracovali, už jsou v důchodu, mimo vědecký svět. Dnes sice tak trochu zažívá comeback, ale lidí, kteří s ním pracují, není moc.

Křeček je dobrý vědecký model, je malý, moc nežere a rychle se množí. (CC)
Pro výzkum jste stvořila geneticky modifikovaného křečka. U myší je zásah do DNA díky technice CRISPR-Cas9 (zjednodušeně CRISPR), která umí editovat v dědičné informaci, dnes už relativně jednoduchý. Jak to šlo s křečkem?
Cesta k němu byla velmi komplikovaná, bolestivá a trvala strašně dlouho. Pro odstraňování nebo přidávání genů jsem využívala stejnou techniku CRISPR jako u myší. Musela jsem ji ale přenést na křečka, což vůbec není jednoduché. Trvalo rok, než jsme se s kolegy dopracovali k výsledku. Zkoušeli jsme všechno možné a až na samém konci jsme našli jednoznačnou chybu, příčinu, proč to nefungovalo. A bohužel se ukázalo, že roli hrála i lidská chyba bývalého kolegy, který připravoval design modelu. U podobných výzkumů nikdo nečeká, že se vše povede hned, ale toto byla už poměrně frustrace.
Pokud se potvrdí mutace acrosinu také u lidí, může být tato informace pro neplodné páry nadějná? Dá se očekávat, že se výsledky výzkumu promítnou do humánní medicíny?
Jde o základní výzkum a udělat krok do humánní medicíny je náročné. Dokážu si ale představit, že by naše výsledky mohly pomoci v případě asistované reprodukce. Mohly by být indikací, kterým směrem se pustit. Pokud by se u muže zjistila mutace, věděli bychom, že není vhodné pokoušet se o in vitro oplození, ale že třeba bude lepší zvolit metodu intracytoplazmatické injekce spermie – tedy rovnou napíchnout spermii do vajíčka, a tím obejít jeho glykoproteinový ochranný obal. Acrosin pomáhá spermii se přes tento obal dostat. Je to ale také otázka personalizované medicíny. Terapie by se měly dělat na míru jednotlivým pacientům. Ve světě už existují centra, kde s páry pracují individuálně a snaží se najít optimální cestu. Tohle bohužel standard není.
Neřeší se tedy příčina neplodnosti?
Ve většině případů jde spíše o výrobu dětí podle standardního schématu. Ženám se nasadí hormonální stimulace a ono to buď klapne, nebo ne. Pokud vím, u velké části párů se prohlásí, že příčina je neznámá. Důvody se neřeší, stejně jako otázka vhodnosti metody.
Geneticky modifikovaná zvířata jsou dnes běžná. Jak se ale díváte na editaci genomů u lidí?
U zvířat je to brnkačka, u nich víme, že všechno funguje. U lidí reprodukční technologie také máme, ostatně děláme děti ze zkumavky, ale problematická je etická otázka. Opodstatnění by měl zásah jen v případě, pokud existuje nějaké zdravotní riziko. Rozumím tomu, že chceme děti vybavit do života zdravé. V Evropě ale zásahy do genomů u lidí nejsou povolené. Výjimku mají myslím jen Finsko a Anglie. Ale jen pro výzkumné účely a po omezenou dobu během embryonálního vývoje. Rozhodně se editovaná embrya nesmějí přenášet ženám.
U nás takové zásahy nejsou legální, to ale neznamená, že jinde je neudělají. Co říkáte na editaci genomu kvůli pohlaví dítěte nebo třeba i barvě vlasů?
Nemělo by docházet k tomu, že si lidé budou vybírat, jestli chtějí kluka, nebo holku. Jenom proto, aby vyhověli nějaké kulturní normě nebo své představě. To mi přijde přes čáru. Lidi by měli být rádi, že dítě vůbec mají, a neřešit jeho pohlaví. Pravda ale je, že si tady můžeme myslet, co chceme, nastavovat pravidla, ale jinde ve světě to mohou vidět a mít jinak.
Nehrozí, že vypukne turistika za editací genomů do zemí, kde takové zásahy budou legální?
Ano a společnost by se měla připravovat, že to jednou pravděpodobně přijde. A asi to nebude v Evropě, která má k takovým genetickým modifikacím jasný postoj.

Je libo dítě dle vašich představ? Editace genomů u lidí zatím povolené nejsou.
Jak už jsme zmínili, sextace, tedy výběr pohlaví, je u zvířat běžná. Je pro vás akceptovatelná?
U nich má svoje místo. Přijde mi přijatelnější včasný zásah, tedy už při výběru spermie nebo embrya, než nechat narodit zvířata, která stejně čeká porážka. Klasicky třeba v chovu slepic, kde se likvidují malí kohoutci, protože nejsou potřeba. Nebo společnosti produkující mléko potřebují dojnice a samce by museli utratit. Vede to pak k velké nadprodukci zvířat a s tím mám etický problém. A navíc, když se zvířata po narození utratí, co pak ty samice, které se vlastně staly matkami? Lepší je proto zasáhnout hned zkraje.
Může možnost výběru pohlaví u zvířat a lidí narušit balanc, harmonii přírody?
To by mě netrápilo. Z globálního hlediska by se zase až tak moc strašného nestalo. Navíc člověk už dnes stojí mimo přírodu, mimo její zákonitosti. Když si vezmete, jak si například prodlužujeme život pomocí moderní medicíny, tak už nějaký balanc přece ani nemáme. Už jsme se příliš vychýlili. A pokud by docházelo k výběru pohlaví, hranici už zase jen trochu posuneme. U zvířat je tomu podobně. Týká se jen hospodářských, která už také stojí mimo přirozený běh.
A jaká budoucnost čeká klonování?
Také s sebou nese spoustu etických otázek a možná i divokých představ o tom, že lidi budou jednou dělat kopie sebe samých. Klonování u lidí je hrozně nepravděpodobné, úspěšnost není dobrá. A pokud úplně pomineme etickou otázku, tak z hlediska byznys modelu je velmi nerentabilní. Možné ale je, že jednou i z klonování bude turistika. Nic nelze vyloučit. Ostatně podobně jsme si mysleli, že u lidí by do lidského genomu pomocí zmiňované techniky CRISPR zasáhl jen blázen. A ejhle, v Číně se tak stalo.
První geneticky upravené děti – dvojčata – přivedl v roce 2018 na svět čínský biolog Che Ťien-kchuej. Je známo, jak se dětem daří?
Nevím, po počáteční vzrušené diskusi je teď klid. Velkou etickou otázkou je, jak děti ovlivňuje fakt, že jsou geneticky upravené, že za ně někdo udělal rozhodnutí a nebyli to ani rodiče. Otázka také je, jestli rodiče skutečně věděli, co se děje, za jakým účelem se vše dělá, dostali potřebné spektrum informací.
Zpráva o geneticky upravených dětech vyvolala ve světě rozruch. Posunula vědeckou debatu ohledně etických otázek spojených se zásahem do našeho genomu?
Podle mě byla otázka času, kdy k tomu dojde. Pro vědeckou komunitu byl zásah spíš nepřijatelný, objevily se ale i souhlasné názory. Stejně jako u klonování. Můžeme si myslet, co chceme, ale neznamená to, že zbytek světa problém vidí stejně.
Čínský vědec „vyrobil“ dvojčata rezistentní na HIV. Mohl by mít jeho zákrok opodstatnění?
U HIV je z hlediska reprodukční medicíny možné použít jiné metody, které jsou vyzkoušené a bezpečnější.
Je genetická úprava technicky bezpečná?
Je relativně bezpečná. Roli hraje zase komplexita systému, protože geny různě interagují. A jestliže si nejsem stoprocentně jistá, což nikdy nemůžu být, že editace genomu vyvolá skutečně jenom, co chci, neměla bych ji dělat. Neexistuje záruka, že se nestane něco jiného. U zvířecích modelů člověk tak nějak bere, že se něco může přihodit. Ale u lidí?
Vám se v roce 2005 podařilo naklonovat myš, navíc na první pokus. Takový výkon zvládlo zatím jen asi patnáct lidí na světě. Zasáhl vám úspěch do kariéry, otevřel nové dveře?
Ani ne. Přenos jader je pro lidi atraktivní, všem se to líbilo. Pro mě ale není nejdůležitější. Jde jen o jednu malou techniku z celého spektra možných mikromanipulací. Dají se dělat mnohem zajímavější věci. Přendávat chromozomy, jádra z různých stadií embrya, různě párovat jádro a cytoplazmu.
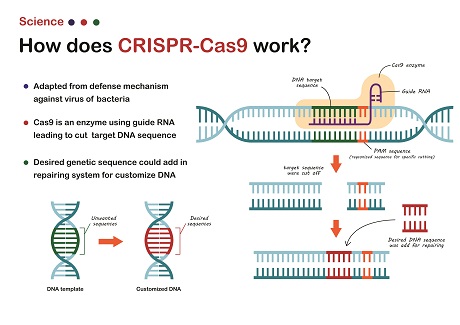
Díky technice CRISPR-Cas9 se genetické zásahy podstatně zjednodušily.
Jdete v rodinných šlépějích. Váš dědeček Josef Fulka založil obor reprodukční biologie a otec Josef Fulka mladší patří v oboru k české špičce. Kdo komu dnes u vás doma radí?
Jak kdy. Ale spíš už se role obrací a radím já, protože hodně věcí zkouším. Možnost doma konzultovat je každopádně výborná. Rodina mi dost pomohla s kontakty na další odborníky. Je super, že vás někdo může trošku postrčit, představit, prolinkovat. Díky tátovi jsme například měli vazby na Japonsko a bylo pro mě pak jednodušší dostat se do laboratoře v institutu RIKEN, který je špičkou v oboru, nebo na Tokijskou univerzitu. Naklonovala jsem tam myš, geneticky modifikovala křečka. Samozřejmě, pokud by to člověk neuměl, tak by mi doporučení otce nepomohlo. Jsme ale malá oblast a všichni vědí, kdo co a jak dělá a čeho je schopný.
Vy jste svět ohromila myší, váš otec s italským týmem naklonoval muflona. Nemáte v sobě touhu naklonovat zvíře, které je třeba na pokraji vyhynutí? Nebo některý již vyhynulý druh zase vrátit do hry?
Nevím, nikdy jsem o tom nepřemýšlela. Je ale otázka, jestli je to dnes vůbec možné a smysluplné. Pokud třeba máme vycpaný exemplář již vyhynulého zvířete, tak i kdyby se ho podařilo naklonovat, všichni jedinci budou stejní. Mohli bychom si udělat populaci, dát ji do ZOO a tam o ni pečovat, protože se u zvířat mohou objevit různé problémy. My například v laboratoři používáme geneticky identické myši a některé se špatně množí, postupně třeba ohluchnou, oslepnou. U zvířat na pokraji vyhynutí jde o stejný problém. Populace je životaschopná jen v případě, pokud existuje variabilita. A často je tak malá, že už nezmůžeme nic ani s našimi technologiemi, už je téměř pozdě.
Němci se aktuálně snaží pomocí asistované reprodukce oživit ohroženého nosorožce bílého, u kterého dnes zůstaly už jen samičky. Jste k takovým pokusům skeptická?
Dokázat, že to jde, je skvělý výstup a počin. Máme povinnost napravovat chyby, které jsme jako lidé udělali. Nebo se aspoň o to pokusit. Otázkou ale je, jestli tou správnou cestou je vyrábět geneticky příbuzné jedince. A co se stane v další generaci, až se tato zvířata mezi sebou začnou křížit.
Jste pověstná svou ohleduplností ke zvířatům. Netajíte se tím, že jste měla problém s experimentováním se zvířaty.
Pokusy na zvířatech jsou kontroverzní, člověk by je nejraději nedělal. Pravdou ale je, že bez nich by medicína nebyla tam, kde dnes je. Bylo by naivní před tím zavírat oči. Je hrozně jednoduché říkat, že nechceme pokusy na zvířatech. Jenže zároveň nechceme, aby nám umíraly děti. Chceme lepší léky, s menšími vedlejšími účinky, aby nás lékaři operovali a zachránili. Ale i když se jim úplně nevyhneme, určitě má smysl se ptát, jestli jsou pokusy odůvodnitelné.
Jeden čas jste byla vegetariánkou. Souviselo rozhodnutí nejíst maso s vaší prací?
Ano, bylo to tak. Říkala jsem si, že některá zvířata využívám při pokusech a jiná pak ještě jím. Spotřeba na jednoho člověka mi přišla moc velká. Pak jsem si ale uvědomila, že vlastně všechno nezachráním, svět nezměním a smířila jsem se s tím. Zároveň si ale myslím, že je povinnost a zodpovědnost lidí, kteří pokusy dělají, zajistit zvířatům dobré podmínky a pokud možno co největší komfort. S tím jsem měla v počátcích kariéry dost problém. Bála jsem se, že jim při manipulaci ublížím.
Kdy jste získala potřebné sebevědomí a přestala se obávat?
Do určité míry mám obavy pořád. Za léta praxe už jsem si ale mnohem jistější. Chybou českého prostředí je, že se u nás běžně neprochází institucionalizovaným tréninkem. Že člověk nemusí v praxi demonstrovat, že je se zvířaty schopen pracovat, že to zvládá. Třeba v USA nebo Austrálii vás nepustí k práci se zvířaty, dokud neabsolvujete výcvik, neukážete před komisí, že s nimi pracovat umíte, a nezískáte certifikát. Mně moc pomohlo, že jsem tím prošla, certifikát mi dal jistotu. V českém prostředí stačí vyplnit test. Spoléhá se na jednotlivé laboratoře a nadřízené, že by lidi nenechali dělat se zvířaty, kdyby to nebylo dobré.
Vy jste údajně měla v Japonsku něco jako domov důchodců pro pokusná zvířata. Jak fungoval?
Nikdy jsem nebrala zvířata do pokusů jen jako materiál. U velkých chovů chápu, že je potřeba uvolnit místa a zvířata utratit. I když je možné si práci lépe zorganizovat a zbytečně neprodukovat další modely. V Japonsku jsem si to zařídila tak, že jsem si mohla nechat myši, které si už odsloužily svoje. Musela jsem jim ale najít novou roli. A tak jsem třeba myší matky, které měly přenesená embrya a už by nebylo dobré je do pokusů použít, dávala k jiným myším, aby jim dělaly společnost, protože myši jsou sociální. Běžně se v praxi ve většině případů odstaví od mláďat a utratí. Praktikovala jsem takový udržitelný způsob. Člověk si totiž pak rozmyslí, o kolik myší se musí starat, kolik má prostoru, kolik jich vlastně potřebuje.
Zaznamenala jste ve vašem oboru trend počet zvířecích modelů redukovat?
Díky technice CRISPR, která umí pomocí genetických nůžek v dědičné informaci editovat, vystřihuje genetické informace, vkládá, tlumí nebo probouzí jednotlivé geny, se naše práce velmi zjednodušila a zrychlila. Nastala vlna, kdy se modely vyráběly jako o život. Lidé ale přestali rozmýšlet, jestli je skutečně potřebují. Dřív byly genetické zásahy hrozně nákladné a pracné. Vědci si museli rozmyslet, jestli to opravdu chtějí a mají dostatek podpůrných argumentů, proč daný gen studovat. Naštěstí, jak se mi zdá, hlavní boom generování modelů spíše upadá a vracíme se zpět k většímu rozmyslu a smysluplnému plánování.
Vědci hledají způsob, jak reprogramovat buňky s genetickou vadou. Mluví se o tom, že jednou možná budeme na 3D tiskárnách tisknout nové orgány s opravenými buňkami. Vidíte to reálně?
Velkou nadějí byly iPS buňky, které je možné přeprogramovat. Japonec Šinja Jamanaka za jejich objev dostal Nobelovu cenu. Pak se ale ukázalo, že z hlediska medicíny aplikace vůbec není tak jednoduchá, jak na začátku vypadala, iPS buňky přeci jenom mají nějakou svoji paměť, takže reprogramace není stoprocentní. Využití v humánní medicíně je proto v tuto chvíli nepřijatelné a pořád existuje spousta otázek.
Asi až příliš futuristická představa. Možnost omladit buňky, z vlastních buněk vyrobit nové orgány – nesměřujeme k elixíru mládí, k dlouhověkosti?
I kdybychom byli relativně schopní nahradit orgány, pořád musíme mít na mysli komplexitu systému. A otázkou je, jestli je to vůbec cesta k dlouhověkosti. Jedna věc je v nějakém rozumném věku nahradit člověku orgány, což určitě dává smysl. Ale markantní prodloužení života? To myslím, že tak jednoduché nebude. A možnost omlazení buněk? Zatím neumíme ani pořádně odstranit jejich paměť. To jsou otázky, na které v tuto chvíli podle mě nikdo nezná odpověď.

Mgr. Helena Fulková, Ph.D.
Ústav Experimentální medicíny AV ČR
Vystudovala biologii na Přírodovědecké fakultě UK, obor vývojová biologie. Deset měsíců strávila na Tokijské univerzitě, kde v roce 2015 naklonovala myš. O dva roky později v japonském institutu RIKEN geneticky upravila křečka a potvrdila roli enzymu acrosin při oplodnění. Pracovala v Ústavu molekulární genetiky AV ČR a dnes vede výzkumnou skupinu v Ústavu experimentální medicíny AV ČR. Ve volném čase ráda plave, hraje squash a věnuje se klasickému tanci. (CC)
4/2021 (verze k listování)
4/2021 (verze ke stažení)
Text: Zuzana Šprinclová, Divize vnějších vztahů SSČ AV ČR
Foto: Jana Plavec, Divize vnějších vztahů SSČ AV ČR; Shutterstock
 Text, úvodní fotografie a snímky označené (CC) jsou uvolněny pod svobodnou licencí Creative Commons.
Text, úvodní fotografie a snímky označené (CC) jsou uvolněny pod svobodnou licencí Creative Commons.
Přečtěte si také
- Breberky mě fascinovaly odmala, říká mikrobiolog Michal Kraus
- Učíme se, vybavujeme si a zapomínáme. Co dokáže paměť a jak ji přelstít?
- Nádorové buňky jako zlodějky. Jak posílit imunitní systém, aby na ně vyzrál?
- Nová sloučenina chrání kostní buňky, může pomoci pacientům s cukrovkou
- Růst listů, kořenů, kvetení i rozmnožování aneb Za vším hledej hormon
- Řekni mi to vůní. Pachová komunikace řídí životy zvířat i lidí
- Luční kvítí klíčem k poznání evoluce. Vědci popsali DNA chromozomu Y
- Jak se mozek zotavuje po mrtvici? Odpovědi přináší studie českých vědců
- Čirok produkuje unikátní pyl. Může být cestou k pěstování odolnějších plodin
- Jak opravit míchu: Kristýna Kárová zkoumá možnosti obnovy nervových buněk
Biologie a lékařské vědy
Vědecká pracoviště
- Biofyzikální ústav AV ČR
Biotechnologický ústav AV ČR
Fyziologický ústav AV ČR
Mikrobiologický ústav AV ČR
Ústav experimentální botaniky AV ČR
Ústav experimentální medicíny AV ČR
Ústav molekulární genetiky AV ČR
Ústav živočišné fyziologie a genetiky AV ČR
Cílem výzkumu je poznávání procesů v živých organismech, a to na úrovni molekul, buněk i organismů. Biofyzikální výzkum se zabývá studiem vztahu DNA – protein a vlivu faktorů životního prostředí na organismy. V oblasti molekulární genetiky a buněčné biologie jsou studovány zejména signální cesty pro spouštění reakcí a odezvy cílových genů na tyto signály; zvláštní pozornost je věnována studiu buněčných mechanismů imunitních odpovědí. Sledovány jsou rovněž genomy mikroorganismů a procesy směřující k moderním technologiím přípravy látek s definovanými biologickými účinky. V oblasti fyziologie a patofyziologie savců a člověka je výzkum zaměřen na kardiovaskulární fyziologii, neurovědy, fyziologii reprodukce a embryologii s cílem vytvořit teoretické základy preventivní medicíny. V oblasti experimentální botaniky se výzkum věnuje genetice, fyziologii a patofyziologii rostlin a moderní rostlinné biotechnologii. Sekce zahrnuje 8 vědeckých ústavů s přibližně 1930 zaměstnanci, z nichž je asi 690 vědeckých pracovníků s vysokoškolským vzděláním.
