
Enzym „ptakopysk“ pomůže s vývojem nových účinnějších antibiotik
26. 07. 2023
Vývoj nových antibiotik je jednou z globálních zdravotnických výzev dneška. Pracovníci z Mikrobiologického ústavu AV ČR nyní v mezinárodní spolupráci s Tokijskou univerzitou vyřešili strukturu klíčového kondenzačního (spojovacího) enzymu, který se využívá pro biosyntézu antibiotik, a objasnili, jak funguje na molekulární úrovni. Enzym je podle vědců jedinečný, protože spojuje unikátní jednotky ojedinělým způsobem. Vědci jej přirovnávají k ptakopyskovi, který zdánlivě také pochází z různých zvířat. Studii publikoval časopis Nature Catalysis.
Látky účinné i proti obávaným zlatým stafylokokům a jiným nebezpečným bakteriím připravují vědci z Akademie věd ČR ve spolupráci s českou firmou Santiago Chemicals už několik let. Vycházejí z výzkumu, který začal už v roce 2017 pod vedením Jiřího Janaty, vedoucího laboratoře biologie sekundárního metabolismu v Mikrobiologickém ústavu AV ČR.
Tehdy vědci přišli s novým, účinnějším antibiotikem CELIN, které kombinuje stavební kameny dvou přírodních látek – celesticetinu a linkomycinu. Kombinovat linkomycin s málo aktivním celesticetinem do té doby nikoho nenapadlo. Chemicky je to velmi komplikované a po celá desetiletí chyběly vědcům potřebné znalosti. V současnosti jsou výsledkem úspěšné spolupráce desítky odvozených látek, přičemž několik z nich je účinných i proti bakteriím rezistentním k antibiotikům.
Zlatý stafylokok může způsobit mnoho různých onemocnění, projevuje se například kožní infekcí, rýmou, horečkou, bolestí v krku. Jindy také bolestí břicha, průjmem či zvracením.
V současnosti učinili odborníci v rámci projektu Národního institutu virologie a bakteriologie další přelomový krok, když s týmem profesora Ikura Abe z Tokijské univerzity objasnili strukturu podivného enzymu. Ten je zásadní pro přípravu zmiňovaného celesticetinu, bakteriostatického antibiotika.
Enzym, který pomůže při vývoji nových antibiotik účinných proti rezistentním bakteriím, spojuje unikátní jednotky ojedinělým způsobem. Svou strukturou se vymyká jakémukoli známému proteinu. Na molekulární úrovni jej lze přirovnat k ptakopyskovi, který jako by byl poskládaný z různých zvířat.
„V letech 2015 až 2018 jsme výraznou měrou přispěli k vyřešení podivuhodné biosyntézy linkosamidových antibiotik celesticetinu a linkomycinu, v nichž se jednotlivé stavební kameny sestavují jako v molekulární verzi stavebnice Lego. Když jsme si tyto principy vyzkoušeli při konstrukci hybridní látky CELIN, napadlo nás, že by naše stavební možnosti byly výrazně širší, kdybychom rozuměli funkci zásadních enzymů z biosyntézy přírodních linkosamidů,“ vysvětluje Jiří Janata.
Výjimečné výsledky díky česko-japonské spolupráci
Už podle sekvence zkoumaných enzymů (pořadí aminokyselin v nich) bylo jasné, že budou hodně odlišné od všech dosud známých proteinů. „Mě fascinoval klíčový kondenzační enzym, nepodobal se vůbec ničemu. Intuice v biologii říká, že právě unikátní systémy přinášejí ta nejzásadnější překvapení a přelomové objevy. Oslovil jsem tehdy profesora Abe, který se zabývá právě takovými neobvyklými enzymy takzvaného speciálního neboli sekundárního metabolismu přírodních látek, a domluvili jsme spolupráci při řešení struktury a funkce právě publikovaného kondenzačního enzymu,“ popisuje vznik spolupráce s japonskou skupinou Jiří Janata. Ta se postupně rozšířila o další tři proteiny klíčové pro skládání a opracování stavebních kamenů antibiotik.
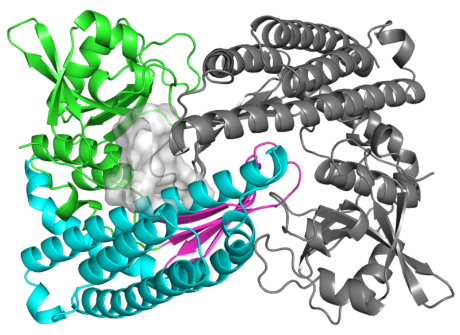
Enzym se svou strukturou vymyká jakémukoli známému proteinu. Vědci jej přirovnávají k ptakopyskovi, který zdánlivě také pochází z různých zvířat.
Náročná a nejistá cesta k úspěchu
Strukturu základní formy kondenzačního enzymu vyřešil Stanislav Kadlčík z Mikrobiologického ústavu AV ČR, který v roce 2019 pobýval jako postdoktorand v tokijské skupině. „Studiu struktury proteinu předchází jeho čištění a krystalizace, což je dlouhá a nevyzpytatelná práce bez jistoty úspěchu. Každý protein vyžaduje specifické podmínky. Když máte štěstí a podaří se získat krystal proteinu v kvalitě dostatečné pro měření struktury, není ještě vyhráno a jste tak ve třetině cesty k cíli. K vyřešení mechanismu funkce neobvyklého proteinu musíte mít i krystaly se substráty enzymu, často právě tak neobvyklými a tedy nedostupnými. A pak se musí připravit a otestovat upravené formy enzymu. Takový výzkum trvá i několik let a kdykoli můžete narazit,“ vysvětluje náročnou práci Stanislav Kadlčík.
Cestou je porozumění řeči mikroorganismů
Přirovnání výstavby antibiotika z jednotlivých stavebních dílů ke skládačce Lega není náhodné. Antibiotika jsou speciálními molekulárními stavbami na míru, přesně zapadají do zásadních biologických struktur mikroorganismů. Proto jsou tak účinná jen proti bakteriím a pro člověka jsou neškodná. Rezistence k antibiotikům nějakým způsobem tuto do sebe zapadající skládačku ruší a antibiotika přestávají fungovat.
Odbornice na antibiotickou rezistenci Gabriela Balíková Novotná z laboratoře biologie sekundárního metabolismu doplňuje: „V přírodě vedle sebe po miliony let existují antibiotika i rezistence, a přesto antibiotika přetrvávají. Antibiotika a rezistence jsou totiž dvěma nedílnými součástmi širšího systému chemické komunikace mikroorganismů, zjednodušeně řečeno bakterií.“
Když podle jejího názoru z přírody odpozorujeme tyto principy, takříkajíc porozumíme řeči bakterií, můžeme v budoucnu léčit infekční nemoci zcela novým způsobem. Nebude například nutné infekční agens antibiotiky zabít. Namísto toho bude možné patogenním bakteriím vyslat signály, které je přesvědčí k ústupu. Bude to taková informační válka namísto té likvidační.
Text: Markéta Wernerová, Divize vnějších vztahů SSČ AV ČR, s využitím tiskové zprávy AV ČR
Foto: Shutterstock (2); Mikrobiologický ústav AV ČR
Přečtěte si také
- Breberky mě fascinovaly odmala, říká mikrobiolog Michal Kraus
- Učíme se, vybavujeme si a zapomínáme. Co dokáže paměť a jak ji přelstít?
- Nádorové buňky jako zlodějky. Jak posílit imunitní systém, aby na ně vyzrál?
- Nová sloučenina chrání kostní buňky, může pomoci pacientům s cukrovkou
- Růst listů, kořenů, kvetení i rozmnožování aneb Za vším hledej hormon
- Řekni mi to vůní. Pachová komunikace řídí životy zvířat i lidí
- Luční kvítí klíčem k poznání evoluce. Vědci popsali DNA chromozomu Y
- Jak se mozek zotavuje po mrtvici? Odpovědi přináší studie českých vědců
- Čirok produkuje unikátní pyl. Může být cestou k pěstování odolnějších plodin
- Jak opravit míchu: Kristýna Kárová zkoumá možnosti obnovy nervových buněk
Biologie a lékařské vědy
Vědecká pracoviště
- Biofyzikální ústav AV ČR
Biotechnologický ústav AV ČR
Fyziologický ústav AV ČR
Mikrobiologický ústav AV ČR
Ústav experimentální botaniky AV ČR
Ústav experimentální medicíny AV ČR
Ústav molekulární genetiky AV ČR
Ústav živočišné fyziologie a genetiky AV ČR
Cílem výzkumu je poznávání procesů v živých organismech, a to na úrovni molekul, buněk i organismů. Biofyzikální výzkum se zabývá studiem vztahu DNA – protein a vlivu faktorů životního prostředí na organismy. V oblasti molekulární genetiky a buněčné biologie jsou studovány zejména signální cesty pro spouštění reakcí a odezvy cílových genů na tyto signály; zvláštní pozornost je věnována studiu buněčných mechanismů imunitních odpovědí. Sledovány jsou rovněž genomy mikroorganismů a procesy směřující k moderním technologiím přípravy látek s definovanými biologickými účinky. V oblasti fyziologie a patofyziologie savců a člověka je výzkum zaměřen na kardiovaskulární fyziologii, neurovědy, fyziologii reprodukce a embryologii s cílem vytvořit teoretické základy preventivní medicíny. V oblasti experimentální botaniky se výzkum věnuje genetice, fyziologii a patofyziologii rostlin a moderní rostlinné biotechnologii. Sekce zahrnuje 8 vědeckých ústavů s přibližně 1930 zaměstnanci, z nichž je asi 690 vědeckých pracovníků s vysokoškolským vzděláním.
