Přichází období všudypřítomného pylu. Co všechno víme o alergiích?
25. 03. 2021
Alergické reakce jsou výsledkem vzpoury naší vlastní imunity. Proč se ale bouří a jak bychom ji mohli zklidnit? Napoví nejnovější výzkumy imunitních buněk. Vědci z Ústavu molekulární genetiky AV ČR studují složité procesy vedoucí k projevům, které v úhrnu trápí až třetinu populace. Alergiím jsme se věnovali v aktuálním čísle časopisu A / Věda a výzkum.
Aby rostlina poskytla dostatek použitelného pylu, musí se sklidit v pravý čas – ani příliš brzo, ani pozdě. Dorothy Noonová se to za léta praxe naučila perfektně. Zrnka pylu začala sbírat kolem roku 1907, postupně vybudovala celou pylovou farmu zvanou Polinárium (pylové zrno je latinsky granum pollinis).
Pomáhala tím svému bratrovi, imunologu Leonardu Noonovi, ve výzkumu možností léčby pylové alergie. Už tehdy, na počátku 20. století, žilo lidí trpících sezonní alergií ve Velké Británii dost a poptávka po léčbě nepříjemného pálení očí, kýchání a rýmy byla poměrně značná.

Imunolog Leonard Noon ve své laboratoři zkoumal možnosti léčby pylové alergie.
Leonard Noon s Johnem Freemanem působili v laboratoři sira Almrotha Wrighta, který byl ve své době považován za odborníka na vakcinologii, slibně se rozvíjející medicínský obor. Oba mladí muži byli zapálenými vědci. „Skoro jsme nevycházeli z laboratoře, bývali jsme v ní do půlnoci, často pracovali do dvou, do tří do rána, někdy až do svítání,“ vzpomínal John Freeman po letech.
Jak Leonard, tak John, které pojilo přátelství od chlapeckých let, se díky svému úsilí dostali do učebnic alergologie, oboru, který se zabývá zkoumáním a navrhováním léčby alergií.
Alergie jako dědictví předků
Pravděpodobně každý z nás zná ve svém okolí někoho, kdo trpí alergií, nejčastěji na pyl, roztoče, pšeničný lepek, mléko nebo třeba oříšky. Rodiče malých dětí se u svých potomků také setkávají s kožní alergií (objevuje se až u pětiny dětí do šesti let). Obecně se alergie definuje jako nepřiměřená reakce imunitního systému na různé látky z okolí, původně zcela neškodné. Říká se jim alergeny a obvykle jde o bílkoviny rostlinného nebo živočišného původu.
Už za života sourozenců Noonových představovaly alergie medicínský problém a podle historických pramenů se s nimi potýkali i obyvatelé starého Řecka a Říma. Je tedy pravda, že je dnes alergiků více než v minulosti? Vzhledem k absenci přesných dějepisných statistik to nelze tvrdit s naprostou jistotou. Ví se ale, že náchylnost k alergiím je silně dědičná. Je tedy zjevné, že si ji lidstvo v sobě nese po generace.
Genetický sklon k alergiím se nazývá atopie. Atopických genů už dnes známe stovky a v České republice je má podle zdrojů Všeobecné zdravotní pojišťovny přibližně 40 procent populace, přičemž toto číslo prý postupně lehce narůstá. Nosiči některých z těchto genů mají asi 75procentní pravděpodobnost, že se u nich v průběhu života nějaká forma alergického onemocnění vyvine.
Co se týče celkového počtu alergiků v Česku, udává se, že jde zhruba o třetinu obyvatel. Zjistit přesné číslo není snadné a zřejmě ani možné. Ne každý jde se svými potížemi k lékaři, mnohdy zůstane alergie nepoznána. Největší tuzemská zdravotní pojišťovna uvádí, že specialistu pravidelně navštěvuje každý třetí alergik, to je zhruba desetina populace.

Vědci se domnívají, že římský císař Augustus trpěl bronchiálním astmatem, sezonní rýmou a atopickým ekzémem.
Společně s alergiemi také narůstá diagnostika autoimunitních onemocnění typu diabetes prvního stupně nebo roztroušená skleróza. Tyto trendy se týkají převážně bohatších zemí našeho civilizačního okruhu. Chudší regiony, třeba země subsaharské Afriky, řeší zcela jiné zdravotní problémy.
Dá se říct, že platíme určitou daň z luxusu a čistoty, tedy podmínek, ve kterých v posledních desítkách let žijeme? Tušíme, proč se naše imunita bouří proti vlastnímu tělu a proti neškodným látkám z nejbližšího okolí, například rostlinnému pylu? Víme, jak imunitní systém zkrotit, aby se utlumily jeho nepřiměřené reakce? Podívejme se, co o alergiích napovídají nejnovější vědecké závěry.
K výzkumu příčin a mechanismu alergických reakcí lze přistupovat z mnoha úhlů pohledu. Věnují se mu vědci a vědkyně z několika pracovišť Akademie věd ČR. Jeden z nejvíce detailních vhledů dovnitř nesmírně komplexního světa lidské obranyschopnosti nabízejí laboratoře Ústavu molekulární genetiky AV ČR.
Když imunita spouští alergii
Alergický zánět vzniká nejčastěji v místě kontaktu alergenu s imunitním systémem: v případě pylových alergií jsou postiženy sliznice dýchacích cest, u potravinových alergií sliznice trávicího traktu a u atopické dermatitidy pokožka. Přímou zánětlivou reakci mají na svědomí takzvané žírné buňky (odborně také mastocyty). Vyskytují se roztroušené po těle, nejčastěji právě pod kůží a na sliznicích střeva a plic.
„Žírné buňky jsou klíčovým spouštěčem zánětlivých procesů. Zároveň jsou v určitém směru unikátní a oproti jiným buňkám imunitního systému méně probádané. Začaly se intenzivně studovat až ve chvíli, kdy se zjistilo, jak se dají v laboratorních podmínkách jednoduše izolovat a namnožit,“ vysvětluje Petr Dráber, ředitel Ústavu molekulární genetiky AV ČR a vedoucí oddělení signální transdukce. Intenzivněji se zkoumají teprve poslední čtyři desetiletí.

Petr Dráber je ředitelem Ústavu molekulární genetiky AV ČR. (CC)
Žírné buňky potřebují pro aktivaci alergických reakcí protilátky, jimž se říká imunoglobuliny izotypu E, zkráceně IgE, které se pevně zachycují na jejich receptorech. Produkci protilátek navozuje takzvaný antigen, který může pocházet z vnějšího i vnitřního prostředí (v případě alergií platí synonymum antigen/alergen).
Každá protilátka se váže na specifický antigen (jako když zapadne klíč do správného zámku). IgE je tedy vždy specifický pro daný alergen (proto se před léčbou dělají alergikům podrobné testy IgE protilátek namířených proti různým alergenům).
Pro rozvoj alergií je klíčové, jestli dojde při prvním setkání člověka s alergenem k takzvané senzibilizaci organismu. Laicky řečeno, jestli naše tělo látku rozpozná jako škodlivou a vyvine si systém na její zničení. Zajímavé je, že se tato reakce podobá té, kterou tělo odpovídá na ohrožení parazity.
Pokusme se proces senzibilizace vysvětlit. Klíčovou roli v něm hrají dendritické buňky – jeden z typů buněk rozpoznávajících antigen. Podobně jako žírné buňky se i dendritické nacházejí v kůži, ve sliznicích dutiny nosní a ústní, na plicích, žaludku nebo střevu.
Úkolem dendritických buněk je vyhledávat původce onemocnění neboli patogeny, jejichž fragmenty pak vystavují na svém povrchu. Všimnou si jich buňky bílých krvinek zvané T-lymfocyty, přesněji řečeno Th2-lymfocyty.
K tomu je dobré dodat, že máme dva druhy T-lymfocytů – Th1 jsou naprogramované na přímé zničení patogenů, Th2 na tvorbu protilátek. „Téhájedničková“ odpověď se spouští například při virových infekcích, „téhádvojková“ jako obrana před většími patogeny, jakými jsou paraziti nebo některé bakterie.
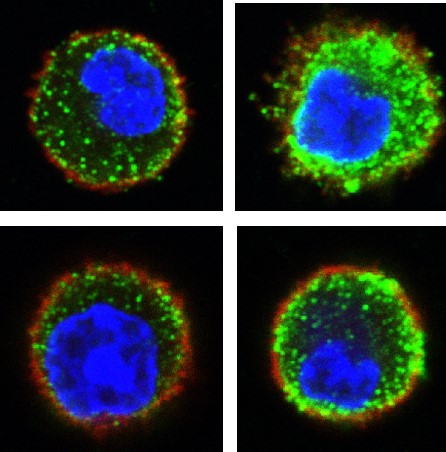
Obrázky z konfokálního mikroskopu ukazují žírné buňky neaktivované (vlevo) a aktivované antigenem (vpravo).
Th2-lymfocyty dají signál dalším buňkám imunitního systému, které známe pod pojmem B-lymfocyty. A to už jsou ty, které mohou vytvářet protilátky. Pokud vytvoří protilátky typu IgG, je vše v pořádku, pokud ale dojde k produkci IgE, mohou vyprovokovat alergii. „To je okamžik, kdy se rozhoduje, jestli se obrana bude, nebo nebude procesovat žírnými buňkami. Vytvořené IgE začne kolovat krevním řečištěm a najde si terčovou buňku, tou je právě žírná buňka s receptory pro IgE,“ říká Petr Dráber.
Většinou je to tak, že se IgE naváže na žírnou buňku a může na ní přetrvávat nějakou dobu. Jakmile se v těle daný alergen objeví znovu, dochází k přímé alergické reakci (přeskakuje se fáze senzibilizace, v akci už jsou přímo žírné buňky způsobující zánět). Proto se alergie u některých lidí projeví i v pozdějším věku a časem se jejich potíže stupňují.
Okamžitá akce a reakce
U alergiků se z nějakého důvodu stává, že namísto parazita pozná dendritická buňka třeba zrníčko pylu. Proč se buňka „splete“, není zatím zcela jasné. Pokud k tomu ale dojde, spustí se „téhádvojková“ odpověď, tedy tvorba protilátek typu IgE, na které citlivě reagují žírné buňky.
„Když se na žírné buňky naváže alergen, odpovídají velice silnou imunologickou reakcí. Za pouhých pár vteřin se v nich spustí bouřlivý proces, který končí tím, že buňka téměř vybuchne a rozprskne svůj obsah do okolí,“ popisuje Petr Dráber. Oním obsahem jsou granula – váčky plné důležitých látek, například histaminu, které zapříčiňují pálení, svědění, kýchání a další projevy zánětlivých reakcí.
Sledovat, co se v žírné buňce po vazbě alergenu na IgE (který je zakotven na buněčný receptor) přesně děje, je nesmírně zajímavé. Současné vědecké metody už to částečně umožňují přímo v živých buňkách. Na videu pořízeném z fluorescenčního mikroskopu můžeme vidět, jak se po aktivaci buněk najednou začnou od buněčného jádra dynamicky rozpínat vlákénka připomínající paprsky žhnoucího slunce. Jedná se o malinkaté trubičky zvané mikrotubuly. Jejich úkolem je dopravit granula z nitra na okraj buňky a následně ven.
„Granula plná aktivních látek se v buňce pohybují podél mikrotubulů, transport přitom zajišťují speciální mikrotubulární motory. To jsou proteiny, které – když mají přísun energie – dokážou přemístit náklad, kam je potřeba,“ popisuje Pavel Dráber, vedoucí oddělení biologie cytoskeletu Ústavu molekulární genetiky AV ČR.

Pavel Dráber z Ústavu molekulární genetiky AV ČR (CC)
Petr a Pavel Dráberovi jsou bratři a shodou okolností se oba věnují výzkumu na žírných buňkách. Tým prvního jmenovaného se zaměřuje na buněčnou signalizaci, druhá skupina pak na detaily cytoskeletu, což je dynamická vnitrobuněčná síť tvořená právě mikrotubuly (a dalšími typy vláken, jako jsou mikrofilamenta a střední filamenta). „Když se sejdeme na nějakém rodinném setkání, téma je jasné. V laboratořích s námi pracují i naše manželky a novou vědeckou skupinu si aktuálně zakládá i syn Peter,“ usmívá se Petr Dráber.
Konkrétně žírné buňky si Petr a Pavel Dráberovi ke své vědecké práci vybrali zhruba před třiceti lety proto, že se jedná o skvělý modelový organismus, na němž se dají studovat detaily buněčné signalizace a regulace cytoskeletu. Prvotní zájem totiž neměli o výzkum alergií jako spíše obecně o studium detailů buněčných pochodů.
Jak alergii léčit?
Podrobné pochopení fungování imunitního systému může ve výsledku vést k pomoci alergikům. Jednou z možností je zablokování zánětlivé reakce žírných buněk. „Dá se toho docílit například prostřednictvím protilátek, které znemožní vazbu IgE na receptory žírných buněk. Tím, že se IgE nenaváže, žírná buňka se alergenem nemůže aktivovat a nedojde k zánětlivé reakci,“ popisuje Petr Dráber princip takzvané imunoterapie.
Jde o léčebný postup, který využívá vysoké specificity protilátek a jejich schopnosti blokovat molekuly s nežádoucími účinky. Imunoterapie se využívá stále častěji zejména u vážných nádorových onemocnění. Anti-IgE protilátky se ale dají použít i u pacientů s velmi silným astmatem a alergií, která je vyřazuje z běžného života. V roce 2018 byla za objev principu této léčby udělena Nobelova cena.
Dosud nejčastěji používanou metodou léčby alergií (nejen) u nás je stále „specifická alergenová imunoterapie“. V jejích počátcích stál před 110 lety Leonard Noon, představený v úvodu článku. V roce 1911 mu otiskl odborný časopis Lancet přelomový text, v němž popsal princip alergenové terapie. Ta spočívá v injekční aplikaci extraktů pylu pod kůži pacientů s postupným navyšováním dávek.
Leonard Noon se domníval, že zrníčka pylu obsahují nějakou toxickou látku. Detaily fungování imunitního systému nebyly tehdy ještě známy, proto k léčbě přistupoval podobně jako k infekčním onemocněním té doby, tedy vývojem očkování. Nakolik jeho metoda bude fungovat a jestli se taková léčba skutečně osvědčí, už se nedozvěděl. O dva roky později zemřel v necelých šestatřiceti letech na tuberkulózu. Jeho metodu dále rozpracoval a první klinické studie zveřejnil přítel John Freeman.
Metoda postupného injekčního vpravování alergenu pod kůži zasahuje do prvotní fáze rozpoznávání antigenu. Díky pomalému a cílenému zaučování imunitního systému se dosáhne výrazného snížení produkce protilátek typu IgE, bez nichž alergen neaktivuje žírnou buňku a nedojde k alergické reakci. Terapie se ale musí opakovat po dobu několika let a vede nikoli k celkovému uzdravení, ale ke snížení příznaků.
Většina alergiků zná testování, jehož účelem je nalézt alergen, na který člověk reaguje.
„Jde o poměrně starou metodu založenou na empirii. Myslím si, že hlavní směr budoucí léčby silných alergiků už bude někde jinde, protože věda pokročila dál. Spíše než na fázi rozpoznávání alergenů se mi zdá účinnější jít na úroveň žírných buněk a blokací IgE receptoru,“ říká Petr Dráber. Pavel Dráber pak doplňuje, že existují látky, které dokážou zasáhnout do procesu aktivace žírné buňky, a tím utlumit nebo zastavit jejich alergickou činnost.
V roce 2018 například v laboratoři zkoušeli účinky miltefosinu, látky, která se používá při léčbě parazitární leishmaniózy, ale potlačuje i atopické ekzémy. Předpokládalo se, že působí na úrovni buněčné membrány a ovlivňuje signální dráhy vedoucí k uvolňování vápníku, který funguje jako spouštěč pro kaskádu dějů v žírné buňce. Vědci ověřili, že miltefosin skutečně velmi rychle vstupuje dovnitř buňky, kde ovlivňuje procesy přenosu signálů, a inhibuje tak aktivaci žírných buněk.
Další cestou je hledat látky, jež ovlivní funkce mikrotubulů a jejich motorů při transportu granul. Dynamiku mikrotubulů reguluje například taxol. „V současnosti se úspěšně používá v medicíně při léčbě nádorů. Po jeho aplikaci ve velmi nízkých koncentracích mikrotubuly zamrznou, nemohou růst a nádorové buňky se pak nemohou dělit. Stejně tak u žírných buněk vede ovlivnění dynamiky mikrotubulů k inhibici i uvolnění granul se zánětlivými látkami,“ dodává Pavel Dráber.
Jeho laboratoř dále hledá signální molekuly, které by ovlivnily nukleaci žírných buněk. Jedním z důležitých proteinů v tomto procesu jsou gama tubuliny, vytvářející prstence, z nichž vyrůstají mikrotubuly. „Myslím, že budoucností léčby alergií jsou právě látky, které budou umět inhibovat proteiny signálních cest. Objevují se postupně desítky až stovky takových možných látek. Je ale potřeba vše pořádně prozkoumat, aby neublížily, aby třeba nezacílily na jiné buňky,“ uzavírá Pavel Dráber.
Drsná škola imunitních buněk
Zasáhnout by se dalo nejen na úrovni žírných buněk, ale i na jiných místech imunitního systému. Například ve fázi „výcviku“ T-lymfocytů. Největší „výcvikové středisko“ těchto bílých krvinek se nachází v brzlíku (thymu), malém lymfatickém orgánu schovaném v hrudním koši.
Aby mohly T-lymfocyty neboli T-buňky jako správní vojáci napadat ty pravé nepřátele, musejí projít drsným školením, při němž si vytvářejí na svém povrchu senzory (receptory). Můžeme si je představit jako důlky, do nichž zapadne určitá bakterie či jiný patogen. T-lymfocyty se ale musejí přesně naučit, které molekuly jsou škodlivé a které ne. Roli učitele přitom zastávají thymové epitelové buňky (mTECs).
„Zkoušku dospělosti v tomto krutém výcvikovém středisku zvládne jen asi pět procent buněk. Celých 95 procent jich zahyne. Z tohoto pohledu se vlastně jedná spíše o jatka než o školu,“ říká Dominik Filipp, vedoucí oddělení imunobiologie Ústavu molekulární genetiky AV ČR.

Dominik Filipp z Ústavu molekulární genetiky AV ČR (CC)
Taková jatka jsou ale více než potřebná, protože kdyby buněk schopných zareagovat na molekuly vlastního těla prošlo víc, stoupá riziko, že u nás propukne nějaká forma autoimunitního onemocnění (například roztroušená skleróza).
Drsné výcvikové středisko přežijí dva druhy T-buněk. Ty, které budou schopné pronásledovat skutečné patogeny (mikroby, parazity, viry…), a skupina neurčitých buněk na rozhraní. Z nich vzniká speciální populace regulačních buněk neboli Tregů. „Můžeme si je představit jako policisty, kteří kontrolují nadbytečné reakce naší imunity. Jinak řečeno, jde o nepostradatelné buňky, které mohou tlumit jednak reakce autoimunitní a také reakce alergické,“ říká Dominik Filipp.
Špína, která posiluje imunitu
Výzkumnému týmu Dominika Filippa se podařilo prokázat, že procesu generování těchto superpolicistů napomáhají speciální Toll receptory, které vnímají přítomnost bakterií. V brzlíku, kde se „školí“ T-lymfocyty, sice celé bakterie běžně nejsou, ale bakteriální produkty se přenášejí po celém těle. Přitom nejvíc je jich ve střevě, které se někdy označuje za nejdůležitější imunitní orgán. V symbióze s námi v něm žijí miliardy bakterií. „Co přesně spouští signály pro tvorbu Tregů, zatím nevíme, ale dá se předpokládat, že mohou přicházet právě ze střeva,“ zmiňuje Dominik Filipp.
V krevním řečišti člověka jsou stovky, možná tisíce bakteriálních metabolitů, o kterých zatím vědci netuší, co dělají. O několika z nich vědí, že stimulují imunitní systém. Jasné je, že většinu bakterií jsme si vyselektovali v průběhu evoluce, protože nám pomáhají. Miliony let budovaná rovnováha se ale v posledních dekádách narušuje. Lidé (v našem civilizačních okruhu) žijí v čím dál čistějším prostředí, obvykle v mnohem menším kontaktu s přírodou, než žili jejich předkové.
Imunologové se přitom shodují, že nastavení imunity se děje od raného dětství. Podstatné je kojení, prostřednictvím kterého předává matka svému potomku protilátky. Děti by navíc od útlého věku měly být v kontaktu s přírodou, hodně chodit ven a hrát si třeba na písku. „Ten obsahuje mimo jiné velmi zajímavé mykobakterie. Malé děti si často dávají něco do pusy a tím se jim do střeva dostávají i mikroby, na nichž se jim trénuje imunitní systém,“ říká Dominik Filipp.
Vedle pobytu venku doporučuje také ranou předškolní docházku. „Je to sice náročné pro rodiče, děti jsou zpočátku věčně nemocné, ale pro jejich imunitní systém je potřeba, aby se setkal s infekcemi a vybudoval si paměťové buňky, které použije v boji s pozdějšími infekcemi,“ dodává imunobiolog. Zkrátka imunitní systém musí pracovat a trénovat se od samého počátku, jinak se nudí a může se obrátit proti vlastnímu tělu.
Věda se díky novým metodám posouvá rychle kupředu, studují se neskutečné detaily, o kterých ještě v době Leonarda Noona badatelé neměli ani ponětí. Jenže čím víc se dozvídáme, tím hlouběji do neznáma pronikáme. Vyřešíme jeden medicínský problém a objeví se další. Odstranili jsme ze svých životů mikroby a parazity, abychom se zbavili infekcí, a imunitní systém nám to vrací autoimunitními chorobami a alergiemi.
Bakterie, paraziti, extrakty alergenů pod kůži, cílené zásahy do působení imunitních buněk… Která z terapií může mít největší úspěch? Jasné pouze je, že imunitní systém je nesmírně složité zařízení, kde vše souvisí se vším. A také že vše chce svůj čas. Podobně jako při budování pylové farmy, kterou Dorothy Noonová vedla po bratrově předčasné smrti dalších čtyřicet let.
|
Pyl jako biologická zbraň První pylová zrna se objevují ve vzduchu už koncem ledna a v únoru (olše a líska). Výraznější sezóna pak začíná v březnu. Postupně vykvétají další druhy rostliny až do konce září, případně října (poslední bývají ambrózie, pelyněk a rákos). Alergenní bývají nejčastěji pylová zrna větrosnubných druhů, tedy takových, které se šíří vzduchem. „Uletí i stovky kilometrů daleko, snadnému vdechnutí napomáhá i velikost zrn, v průměru dosahují od deseti do sta mikrometrů,“ říká Jan Fíla z Ústavu experimentální botaniky AV ČR. Jako alergen mohou působit povrchové glykoproteiny obalující pylová zrna, některá zrna také vylučují látky ze své cytoplasmy, například enzymy štěpící bílkoviny (proteázy), které pak poškozují lidské buňky. |
Tento článek i další zajímavé texty najdete v časopise A / Věda a výzkum, který vydává Akademie věd ČR.

1/2021 (verze k listování)
1/2021 (verze ke stažení)
Text: Leona Matušková, Divize vnějších vztahů AV ČR
Foto: Shutterstock; Wikimedia Commons; Jana Plavec, Divize vnějších vztahů AV ČR; archiv Ústavu molekulární genetiky AV ČR
 Text a fotografie označené (CC) jsou uvolněny pod svobodnou licencí Creative Commons.
Text a fotografie označené (CC) jsou uvolněny pod svobodnou licencí Creative Commons.
Přečtěte si také
- Breberky mě fascinovaly odmala, říká mikrobiolog Michal Kraus
- Učíme se, vybavujeme si a zapomínáme. Co dokáže paměť a jak ji přelstít?
- Nádorové buňky jako zlodějky. Jak posílit imunitní systém, aby na ně vyzrál?
- Nová sloučenina chrání kostní buňky, může pomoci pacientům s cukrovkou
- Růst listů, kořenů, kvetení i rozmnožování aneb Za vším hledej hormon
- Řekni mi to vůní. Pachová komunikace řídí životy zvířat i lidí
- Luční kvítí klíčem k poznání evoluce. Vědci popsali DNA chromozomu Y
- Jak se mozek zotavuje po mrtvici? Odpovědi přináší studie českých vědců
- Čirok produkuje unikátní pyl. Může být cestou k pěstování odolnějších plodin
- Jak opravit míchu: Kristýna Kárová zkoumá možnosti obnovy nervových buněk