Novou studii parazitologů vybral prestižní časopis Current Biology jako stěžejní článek čísla
19. 11. 2018
Jak přesně fungují proteinové „stroje“ v buněčných elektrárnách eukaryotických organismů, popisuje nová studie parazitologů z Biologického centra AV ČR, která byla publikována na začátku listopadu v prestižním vědeckém časopise Current Biology. Editoři časopisu vybrali studii jako stěžejní článek aktuálního vydání a zpřístupnili ho bezplatně jako tzv. open access on-line.
Mitochondrie, důležitéa starobylé součásti eukaryotických buněk (mezi eukaryota patří živočichové včetně člověka, houby či rostliny), fungují jako buněčné elektrárny, které vyrábějí energii pro celou buňku. Tyto elektrárny mají složitou stavbu, kterou rámují dvě membrány – vnější a vnitřní. Mezi oběma membránami se nachází mezimembránový prostor a zcela uvnitř mitochondrie, uzavřený vnitřní membránou, je tzv. matrix, vnitřní prostor.
Vnitřní membrána má poměrně komplikovanou strukturu. Je zvlněna do záhybů, tzv. krist, které tvarem připomínají prsty natahující se do matrixu. Kristy jsou sídla proteinových komplexů; můžeme si je představit jako molekulární stroje, ve kterých pracuje množství nejrůznějších bílkovin, z nichž každá představuje nepostradatelnou součástku pro správné fungování životně důležitých buněčných procesů, jako je dýchání a vyrábění energie.
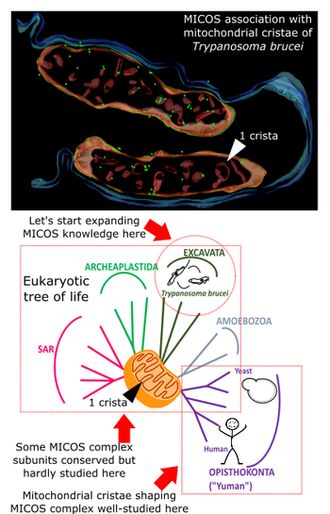
Vzhledem k tomu, že mitochondrie i jejich kristy jsou evolučně starobylé části buněk, vyskytují se v široké škále nejrůznějších eukaryot. Máme je my, lidé, houby a rostliny, ale také naši vzdálenější příbuzní, jednobuněčná eukaryota, tzv. prvoci. Do této různorodé a fascinující skupiny prvoků patří i původce spavé nemoci, parazit trypanozoma spavičná (Trypanosoma brucei). A právě tohoto parazita si vybral tým molekulárních biologů z Parazitologického ústavu Biologického centra AV ČR pod vedením Hassana Hashimiho jako modelový organismus pro výzkum funkcí bílkovinných komplexů vnitřní mitochondriální membrány.
Které části krist jsou společné všem eukaryotům?
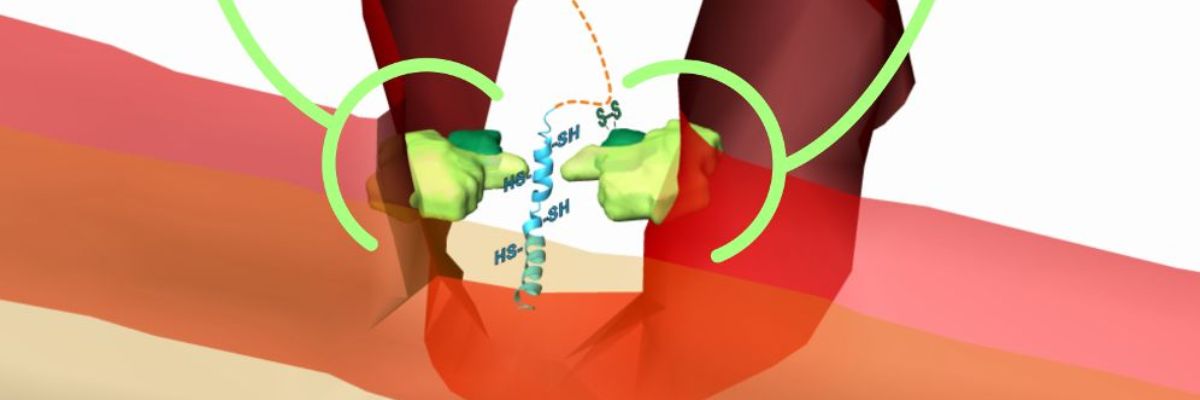
Vědci se rozhodli zodpovědět následující otázky: jaké části výše zmiňovaných molekulárních strojů jsou společné napříč celou říší eukaryot, a jaké části se naopak odlišují a jsou specifické jen pro určité druhy eukaryot? Zaměřili se na bílkovinný komplex MICOS (mitochondrial contact site and cristae organization system). U kvasinek (blízkého příbuzného hub) a člověka (nadále je budeme společně nazývat „kvověk“) je známé, že tento proteinový komplex dává kristám tvar, vytváří místa, kde vnitřní a vnější membrána přicházejí do těsného kontaktu a také kde se připojují kristy ke zbytku vnitřní membrány. Pokud se tento „stroj“ MICOS rozbije, kristy se oddělí od vnitřní membrány a plují v matrixu.
V trypanozomě byl původně nalezen pouze jeden gen pro jedinou bílkovinu komplexu MICOS. Díky této informaci dokázali vědci u trypanozomy izolovat celý bílkovinný komplex MICOS stejným způsobem, jako když vytáhnete viditelnou úchytku šuplíku, abyste se podívali dovnitř, a zároveň se jim podařilo zjistit, v čem je podobný a v čem naopak rozdílný ve srovnání s MICOS u kvověka. Badatelé zjistili, že kontaktní místo vnitřní a vnější membrány i připojení krist k vnitřní membráně jsou stejné jak u trypanozomy, tak i u kvověka. Vzhledem k tomu, že tyto dva typy organismů jsou si příbuzensky tak vzdálené, jak jen si lze představit, lze s jistotou tvrdit, že tato role MICOS je shodná a zásadní napříč všemi eukaryoty.
S pomocí kolegů z Laboratoře elektronové mikroskopie na Biologickém centru mohl tým vědců rovněž přímo pozorovat komplex MICOS na mitochondriálních kristách a sledovat i to, jaké důsledky má genetické odstranění MICOS na tvar krist.
Nečekané rozdíly
Překvapující byly rozdíly, které vědci objevili. Kromě již zmiňované osamělé bílkoviny komplexu MICOS se ostatní proteiny velmi liší od těch, které najdeme u kvověka. Navíc se ukazuje, že jeden z proteinů má úplně odlišnou roli než jakýkoli známý protein u kvověčího MICOS, a sice že pomáhá zachytit proteiny, které patří do mezimembránového prostoru. Mezi proteiny v mezimembránovém prostoru se totiž nacházejí malé proteiny, které jsou součástí bílkovinných komplexů, respiračního řetězu nacházejícího se v kristách.
Tato studie prokazuje, že bílkovinný komplex MICOS u trypanozomy nejen pomáhá dát kristám tvar, ale také umístit proteinové komplexy v té části mitochondrií, která je zodpovědná za buněčné dýchání. Nezodpovězenou otázkou zatím zůstává, zda je MICOS u trypanozomy výjimkou, protožetuto funkci má, anebo zda je výjimkou MICOS u kvověka, když takový protein vůbec nemá.
Kompletní článek z časopisu Current Biology (v angličtině) je k dispozici zde.
Připravilo: Biologické centrum AV ČR ve spolupráci s Odborem mediální komunikace Kanceláře AV ČR
Ilustrace: Biologické centrum AV ČR
Přečtěte si také
- Vědecká rada na návštěvě v Dolních Břežanech
- Akademický sněm uvítal navýšení rozpočtu. „Je to pozitivní zpráva,“ řekla předsedkyně
- Odborníci hovořili o potenciálu a rizicích genetických modifikací
- ČR hostila 68. plenární zasedání ESFRI
- Potřebujeme ucelenou strategii pro boj se suchem, shodují se čeští odborníci
- Bez omezení benzinové a naftové dopravy nelze splnit cíle Pařížské dohody
- Kosti dokážou to, co kůže a krev. Unikátní výzkum publikoval časopis Nature
- Do Fyziologického ústavu putuje ocenění HR Excellence in Research Award
- Nová databáze DNA představuje vzorky ze starodávných lidských populací
- AV ČR vydala stanovisko k evropskému rámcovému programu Horizon Europe