
Vědci dokážou opravit důležitý protein, který brání zhoubnému bujení
28. 05. 2021
Značka „p53“ laikovi nic neřekne. Skrývá se za ní protein, který zamezuje vzniku nádorů. Když se jeho výroba zadrhne, může nastat problém. Petra Beznosková z laboratoře regulace genové exprese Leoše Valáška z Mikrobiologického ústavu AV ČR přišla na to, jak k jeho opravě využít v laboratorních podmínkách molekulu tRNA. A to dosud neznámým způsobem. Výsledky otiskl časopis Nucleic Acids Research.
Bez proteinů by nebyl život. Představují základní stavební kámen všech známých organismů. Zajišťují růst svalů, vlasů, pomáhají okysličovat krev nebo přispívají ke správně fungujícímu imunitnímu systému. Příkladem je protein p53, který brzdí zhoubné bujení ve všech našich buňkách. Současně opravuje poškozenou DNA, proto se mu říká „strážce genomu“. Někdy se ale jeho tvorba zastaví třeba v polovině, takže nemůže plnit kýženou funkci. V laboratoři regulace genové exprese v Mikrobiologickém ústavu AV ČR přišli na to, jak jeho tvorbu v takovém případě alespoň částečně obnovit. Používají k tomu molekuly tRNA, které normálně slouží k něčemu jinému.
Brzda neviditelná i předčasná
Proteiny neboli bílkoviny vznikají v buňce během takzvané proteosyntézy. Vše začíná v jádře buňky, kde je uložena genetická informace. Je příliš cenná na to, aby se s ní manipulovalo, takže vznikne její kopie mRNA (messenger RNA), která putuje z jádra do cytoplazmy. Molekula mRNA plní funkci návodu na výrobu bílkovin. Vypadá jako dlouhá šňůrka s různě navlečenými korálky čtyř barev, kterým se říká nukleotidy. Přistoupí k ní „makromolekulární mašina“ zvaná ribozom – výrobce budoucí bílkoviny. Poté se ke slovu dostává důležitý aktér, kterým jsou transferové molekuly tRNA. Na ribozom postupně přinášejí jednotlivé aminokyseliny, z nichž se skládá protein. Genetická informace v podobě přesně daného pořadí nukleotidů, tedy korálků, určuje jejich správné pořadí. Proces výroby proteinu je vlastně spojováním aminokyselin do různě dlouhého řetízku.
Vědci si ještě donedávna mysleli, že kromě dopravy aminokyselin na ribozom nemají molekuly tRNA žádný jiný význam. Několik nedávných studií však prokázalo, že buňky díky molekulám tRNA také reagují na signály z prostředí. A to buď změnou jejich množství v buňce, různými chemickými modifikacemi tRNA řetězce, popřípadě změnou jeho délky. Molekuly tRNA tak regulují průběh buněčného cyklu, bohužel i v negativním smyslu. „Mohou totiž přispívat k rozvoji četných patologií, mezi které patří rakovina, neurodegenerativní či metabolická onemocnění,“ říká Petra Beznosková z Mikrobiologického ústavu AV ČR.
Jedním z veledůležitých kroků výroby proteinu je přesné ukončení jeho syntézy. Probíhá na takzvaných stop signálech, jež vysílají ribozomu jasný signál: tady končí genetická informace pro daný protein, je potřeba zastavit syntézu. U některých bílkovin se ale vzácně stane, že tRNA tuto stopku úmyslně ignoruje a místo toho k němu přiřadí aminokyselinu. Výroba proteinu tak pokračuje bez přerušení, dokud se neobjeví další, v pořadí druhý a definitivní stop signál. Ve výsledku tak vznikne protein – delší, než by měl být. Může disponovat novými vlastnosti, které buňka v daný okamžik velmi potřebuje. Tomuto jevu se říká programované pročítání stop kodónu.
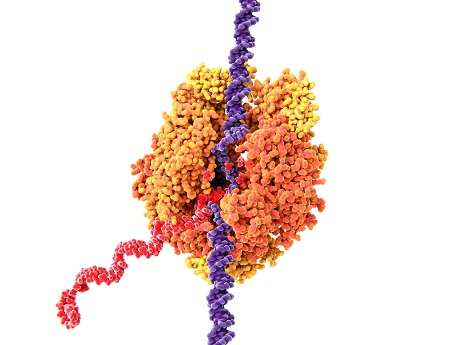
Kulovitý útvar představuje ribozom, z něj pak červeně vychází vlákno s aminokyselinami.
Převrácený postup
Může ale nastat i opačný případ. Více než 15 procent všech lidských genetických onemocnění má na svědomí předčasný stop signál, který se nachází třeba někde uprostřed šňůrky s nukleotidy. V tomto případě dojde k obrácenému jevu. Vznikne kratší protein, jenž neplní svou funkci. Buňky kvůli tomu správně nefungují a organismus strádá. Dochází k závažným poruchám, například v podobě různých syndromů (cystická fibróza, Duchennova svalová dystrofie, β-thalassemia) a řady rakovinových onemocnění.
Vědecký svět se dosud soustředil hlavně na využití chemických látek (readthrough inducing drugs), které by „pomátly“ ribozom tak, aby stop signál uprostřed šňůrky korálků ignoroval a protein připravil v celé jeho délce. Tím by se syndrom jednoduše a elegantně vyléčil. „V praxi to ale vůbec není tak jednoduché a prakticky všechny tyto potenciální léky mají, jak ukazují klinické studie, řadu závažných, vedlejších účinků,“ upozorňuje Petra Beznosková.
Zhruba před pěti lety ji napadlo, že když molekuly tRNA umí v jistých případech ignorovat správný stop signál, třeba by šly využít i pro „pročítání“ těch předčasných. Velkou výhodu by představoval fakt, že tRNA jsou přirozenou součástí našich buněk, nemají pro ně toxický účinek.

Frakcionátor odděluje jednotlivé ribozomální podjednotky od sebe. (CC)
V laboratoři regulace genové exprese pro studium problému nejprve využili modelový organismus pučících pivovarských kvasinek. Díky němu vypozorovali, které tRNA by za tímto účelem mohli použít. Následně ověřili, že kýženého výsledku lze dosáhnout přímo v lidských tkáňových kulturách. Použití tryptofanové tRNA přiměje ribozom, aby syntézu proteinu p53 dokončil, a to navzdory předčasným stop signálům. Jejich výskyt provází a zhoršuje průběh mnoha typů rakovin. Zmíněný protein je totiž za normálních okolností klíčový pro brzdění zhoubného bujení ve všech buňkách našeho těla.
Nová vědecká skupina
„Popsaným zjištěním otvíráme dveře zcela novému výzkumu, díky němuž by snad šlo vytvořit systém, který by využil tuto vlastnost některých tRNA. Významně by to přispělo ke snaze léčit různé typy syndromů a rakovin,“ shrnuje Petra Beznosková. Objev by také mohl pomoci v boji proti lidským patogenům, jako jsou některé viry, jejichž životní cyklus je na programovaném ignorování stop kodónů přímo závislý.
Přehnaný optimismus ale vědkyně mírní. „Na základě posledních výsledků své práce si v současnosti už nemyslím, že by se přirozená tRNA jako taková někdy dala využít jako lék pro tento typ onemocnění. Jsem ale přesvědčena, že získané poznatky se dají využít nepřímo. Ovlivní to vývoj a výzkum léčiv,“ podotýká. Nyní by ráda zřídila vlastní malou vědeckou skupinu. Zaměřit se chce na roli tRNA v regulaci genové exprese. Cílem je hlubší pochopení daného procesu a také budoucí využití poznatků v medicíně.
O výrobě proteinů jsme psali v článku Oceněný mikrobiolog zkoumá, jak fungují buněčné procesy. Dozvíte se v něm o metodě Sel-TCP-seq, kterou vyvinul tým Leoše Valáška v laboratoři regulace genové exprese v Mikrobiologickém ústavu AV ČR. S její pomocí se dají zkoumat jednotlivé kroky buněčné translace, například nalezení přesného začátku i konce genů.
Text: Jan Klika, Divize vnějších vztahů SSČ AV ČR, ve spolupráci s Mikrobiologickým ústavem AV ČR
Foto: Shutterstock; Jana Plavec, Divize vnějších vztahů SSČ AV ČR
 Text a fotografie označená (CC) jsou uvolněny pod svobodnou licencí Creative Commons.
Text a fotografie označená (CC) jsou uvolněny pod svobodnou licencí Creative Commons.
Přečtěte si také
- Breberky mě fascinovaly odmala, říká mikrobiolog Michal Kraus
- Učíme se, vybavujeme si a zapomínáme. Co dokáže paměť a jak ji přelstít?
- Nádorové buňky jako zlodějky. Jak posílit imunitní systém, aby na ně vyzrál?
- Nová sloučenina chrání kostní buňky, může pomoci pacientům s cukrovkou
- Růst listů, kořenů, kvetení i rozmnožování aneb Za vším hledej hormon
- Řekni mi to vůní. Pachová komunikace řídí životy zvířat i lidí
- Luční kvítí klíčem k poznání evoluce. Vědci popsali DNA chromozomu Y
- Jak se mozek zotavuje po mrtvici? Odpovědi přináší studie českých vědců
- Čirok produkuje unikátní pyl. Může být cestou k pěstování odolnějších plodin
- Jak opravit míchu: Kristýna Kárová zkoumá možnosti obnovy nervových buněk