
Vědci popsali interakci proteinů, které jsou klíčové pro stárnutí buněk
28. 04. 2022
Stres spouští v těle celou kaskádu dění. Na buněčné úrovni na něj reaguje také tzv. transkripční faktor p53, který brání tomu, aby se vlivem stresu staly z normálních buněk buňky nádorové. Významnou roli hraje i další transkripční faktor FOXO4. Za stresových podmínek pak tyto proteiny interagují a společně zvyšují produkci proteinu p21, čímž způsobují přechod buněk do tzv. senescentního neboli stárnoucího stavu. Hromadění takových buněk přispívá ke stárnutí organismu. V práci publikované v časopise Protein Science vědecké týmy Veroniky Obšilové z Fyziologického ústavu AV ČR (FGÚ AV ČR) a Tomáše Obšila (Přírodovědecká fakulta UK a FGÚ AV ČR) charakterizovali vzájemné interakce proteinů p53 a FOXO4 na molekulární úrovni. Nové poznatky o struktuře tohoto proteinového komplexu pomohou při vývoji léčiv zaměřených na stárnoucí buňky.
V této strukturní studii vědci podrobně charakterizovali vzájemné interakce proteinů v komplexu FOXO4:p53. Oba samostatně pomáhají organismu, aby se vyrovnal s buněčným stresem, zároveň ale v takových podmínkách interagují a zvyšují produkci jiného proteinu – p21. Ten spouští proces stárnutí buňky (senescenci).
„V tomto stavu se už buňka dále nedělí a produkuje prozánětlivé faktory. Se vzrůstajícím věkem organismu stoupá počet buněk v senescentním stavu, což ho zatěžuje a přispívá ke vzniku různých chorob a celkového zhoršení stavu tkání a i organismu,“ vysvětluje Veronika Obšilová z Fyziologického ústavu AV ČR. „Pokud dojde k narušení interakce p53 a FOXO4, například vhodným inhibitorem, senescentní buňka zahyne a uvolněné místo může využít jiná buňka, která se stále může dělit. Takže pokud snížíme počet buněk v senescentním stavu, dojde k celkovému zlepšení stavu organismu.“
Molekulární mechanismus zvyšování transkripce p21 je však stále nejasný. V článku publikovaném v časopise Protein Science vědci z Fyziologického ústavu AV ČR, Ústavu organické chemie AV ČR a Přírodovědecké fakulty Karlovy univerzity charakterizují vzájemné interakce proteinů p53 a FOXO4 na molekulární úrovni pomocí integrovaného přístupu zahrnujícího nukleární magnetickou rezonanci, analytickou ultracentrifugaci a chemické zesítění spojené s hmotnostní spektrometrií. Takto detailní charakterizace dosud chyběla.
Díky studiu jednotlivých domén (viz obrázek) obou transkripčních faktorů zjistili, co je zásadní pro stabilitu komplexu FOXO4:p53.
Nové poznatky pomůžou pochopit propletené funkce obou proteinů v udržení vnitřní buněčné rovnováhy, dlouhověkosti a při reakci na stres. Naleznou také využití při vývoji specifických inhibitorů (blokátorů) vzájemného působení obou proteinů, a následně pak při vývoji nových léčiv, které se zaměří na selektivní vyřazení stárnoucích (senescentních) buněk.
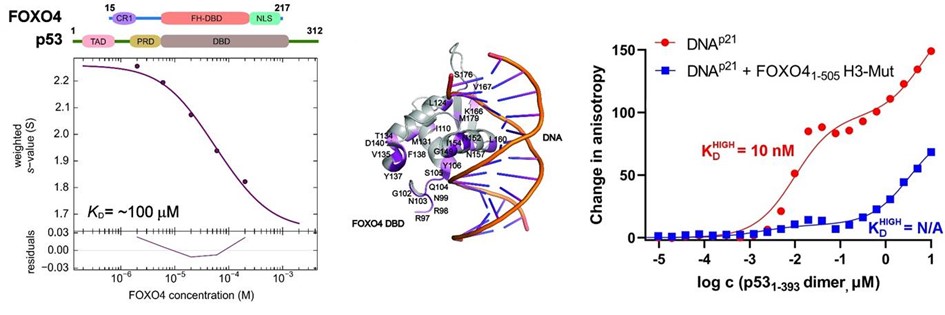
Vlevo: analýza interakce mezi FOXO4 a p53 pomocí analytické ultracentrifugace metodou sedimentační rychlosti. Uprostřed: změny v chemických posunech 15N-značeného FOXO4 v přítomnosti p53 získané z 1H-15N HSQC spekter namapované na krystalovou strukturu komplexu FOXO4 DBD:DNA. Vpravo: měření změn anisotropie fluorescence ukazující, že tvorba komplexu inhibuje vazbu p53 na DNA.
Mandal R, Kohoutova K, Petrvalska O, Horvath M, Srb P, Veverka V, Obsilova V and Obsil T.
FOXO4 interacts with p53 TAD and CRD and inhibits its binding to DNA. Protein Sci. roč. 31, č. 5 (2022), č. článku e4287. IF = 6.725. DOI: 10.1002/pro.4287.
Přečtěte si také
- Rozmanitost rostlin pomáhá ukládat uhlík do půdy – ale ne všude stejně
- Odolnost a (Ne)stabilita budou tématem konference Asociace pro paměťová studia
- Čeští vědci a inženýři se hlásí do evropského vesmírného programu
- Čeští vědci odkrývají záhadné ztráty nástrojů protivirové imunity u ptáků
- Výstava na zámku Vsetín přibližuje sesuvy nejen na Valašsku
- Unikátní způsob recyklace vzácných zemin může posílit surovinovou nezávislost
- Krása v detailu – Brno odhalí tajemství květů
- Hledání druhé Země – vesmírná mise PLATO sestavena, prožila milník v přípravě
- Kosmickému záření na nejvyšších energiích dominují těžké kovy
- Neobyčejná genetika obyčejných šípků – umí dělit lichý počet chromozomů
Kontakty pro média
Markéta Růžičková
vedoucí Tiskového oddělení
+420 777 970 812
Eliška Zvolánková
+420 739 535 007
Martina Spěváčková
+420 733 697 112