
Liběchovské biomedicínské modely pro výzkum závažných chorob
15. 09. 2016

Laboratoř buněčné regenerace a plasticity a nově vybudované výzkumné centrum PIGMOD (Pig Models of Diseases) Ústavu živočišné fyziologie a genetiky AV ČR (ÚŽFG AV ČR) využívají unikátní biomedicínský model – transgenní miniprasata – k základnímu a preklinickému výzkumu neurodegenerativních a neurozánětlivých onemocnění.
Když jsem se před několika lety poprvé vydala podívat se na liběchovská miniprasata, čekala jsem skutečně drobečky, kteří se pohodlně dají vzít do náruče. Omyl – hned při vstupu do prostor s ustájením si proti mně po chodbě vykračovalo prase. Sice znatelně menší než běžná, nicméně pochovat by se sotva dalo, a naprosto pokojně a spokojeně mířilo do svého boxu. Důvod vzápětí vysvětlil s lehce potutelným úsměvem prof. Jan Motlík: „Byl za holkama.“ Díky tomuto „chození za holkama“ – a samozřejmě především mnoha letům soustavné trpělivé práce vědců – se v současnosti mohou v Liběchově pyšnit již několika generacemi transgenních miniprasat. Mini jsou jen trochu – přesně natolik, aby byla v dospělosti váhově i velikostí orgánů velmi podobná člověku; transgenní proto, že byl do jejich genetické informace začleněn mutovaný lidský gen kódující nesprávně tvarovaný protein zvaný huntingtin. Právě mutovaná forma huntingtinu souvisí se vznikem závažného neurodegenerativního a dosud neléčitelného onemocnění zvaného Huntingtonova choroba, jež postihuje především mozek a projevuje se poruchami hybnosti, choreickými, mimovolními, nekoordinovanými pohyby, ale také trvalým úbytkem duševních funkcí a schopností. Komplexní výzkum probíhající v mezinárodní spolupráci se zaměřuje jak na biologickou podstatu Huntingtonovy choroby, tak na hledání a testování nových léků a léčebných postupů. Využívá se přitom škála metodik umožňujících sledovat expresi a uspořádání mutovaného huntingtinu a celistvost DNA. Důmyslnými behaviorálními metodami se sledují i přímé projevy choroby samé, telemetrie pomůže vědcům, včetně dr. Štefana Juháse, získávat nová data o aktivitě miniaturních prasat kontinuálně 24 hodin denně: „Zatím měříme pouze aktivitu, pohyb transgenních miniaturních prasat ve srovnání s kontrolními. Zjistili jsme, že transgenní, momentálně zhruba tříletá mají sníženou aktivitu v určité části dne, konkrétně před ranním krmením, kdy se probouzejí po nočním spánku. Totéž se ukazuje při odpoledním krmení, ale to musíme ještě potvrdit dalšími měřeními. Plánujeme též implantování sond pro měření biopotenciálů, jelikož se jeví i přítomnost jisté patologie srdečního svalu. Je tudíž pravděpodobné, že naměříme i nějaké změny v EKG. A samozřejmě nás zajímá především EEG.“
Transgenní miniprasata byla začleněna i do experimentů, jejichž cílem bude využít nejmodernějších metod genové terapie k potlačení exprese mutovaného huntingtinu.
Zdaleka však nejde o jediný směr výzkumu Laboratoře buněčně regenerace a plasticity a centra PIGMOD ÚŽFG, jak při mé poslední nedávné návštěvě Liběchova připomněl prof. Jan Motlík: „Transgenní miniaturní prasata, která mají v genetické výbavě navíc gen pro lidský mutovaný huntingtin, jsou samozřejmě používána výhradně pro studium této choroby a předpokládá se, že právě na nich budeme schopni pomocí genové terapie dokázat, že jsme schopni utlumit, ne-li přímo zastavit expresi mutovaného huntingtinu. Znamená to, že budeme schopni ona prasátka vrátit ve všech parametrech k normální fyziologii. Je však třeba si uvědomit, že naše transgenní miniaturní prasata jsou heterozygoti, protože huntingtin je bílkovina pro život naprosto nezbytná (ve své normální, nemutované podobě), takže vlastně můžeme mít pouze heterozygoty. To znamená, že v každém vrhu od našich prasnic je vždy 50 % selátek transgenních a 50 % kontrolních – bez mutovaného genu pro huntingtin. A tato kontrolní selátka se používají i na ostatní experimenty, v nichž potřebujeme mít všechny parametry naprosto fyziologické.“
Vývoj příslušných biomedicínských modelů a nových metod aplikace léčiv, růstových faktorů atp. umožnil ÚŽFG provádět též základní a preklinický výzkum dalších závažných chorob, především amyotrofické laterální sklerózy, dále studium léčby poškození míchy pomocí buněčné terapie, konkrétně xenotransplantace lidských míšních, neurálních prekurzorů do poškozené míchy miniprasat a také výzkum bezpečnosti i účinnosti této transplantace. Významnou roli přitom hraje spolupráce s prof. Martinem Maršalou z Kalifornské univerzity v San Diegu: „Náš společný experiment začal zhruba před 10 lety, když vznikla potřeba vyvinout velký model traumatického poškození míchy – velký ve smyslu využití velkých zvířat. Právě liběchovské pracoviště bylo unikátní, protože takový model mělo: dostupná zvířata s velmi dobře definovaným genetickým fondem. Tehdy jsme společně s prof. Janem Motlíkem a dr. Štefanem Juhásem navrhli projekt vytvoření modelu poškození míchy u prasat. Ukázali jsme – což bylo velmi důležité –, že z hlediska patologie míchy i neurologického poškození má prasečí model velmi blízké charakteristiky míšního poškození pozorovaného u lidských pacientů. To byl první krok k testování buněčných transplantací s využitím tohoto modelu, k otestování bezpečného počtu buněk, které mohou být vpraveny do míchy podobné velikosti, jako je u lidí. Vše v konečném důsledku vyústilo v použití jedné z buněčných linií v klinických zkouškách v USA. V San Diegu jsme ukončili testy se čtyřmi pacienty s chronickým poškozením míchy, kterým byly injikovány stejné buňky, s nimiž jsme prováděli experimenty tady v Liběchově.“
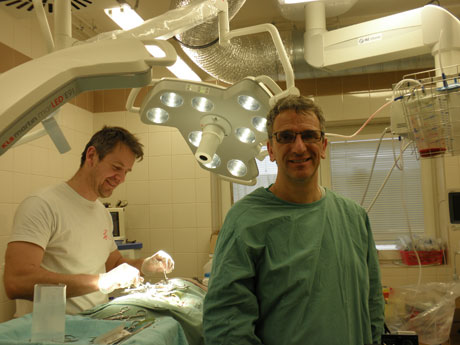
Foto: Jana Olivová, Akademický bulletin
Štefan Juhás (vlevo) a Martin Maršala na operačním sále
Ve spolupráci s prof. Maršalou a také se dvěma ústavy Slovenské akademie věd v Košicích byl v liběchovské Laboratoři buněčné regenerace a plasticity vyvinut i potřebný počítačem řízený kompresní model poškození míchy u miniaturního prasete, který věrně napodobuje poškození míchy u člověka a využívá se zejména pro preklinické testování nově vytvořených neurálních buněčných linií. Podle dr. Š. Juháse se nyní realizují bezpečnostní studie, v jejichž rámci se lidské fetální kmenové buňky schopné diferencovat převážně do neuronů aplikují do nepoškozené míchy miniaturních prasat: „Cílem je určit, jaký maximální počet injekcí a jakou maximální koncentraci buněčné suspenze je prasečí organismus ještě schopný tolerovat, aniž by došlo k poškození míchy. Jinými slovy, chceme zjistit, jaká dávka je ještě bezpečná, aby u miniaturních prasat nezpůsobila nějaký klinický, ať už motorický, nebo senzorický deficit.“
Martin Maršala dodává, že ještě předtím, než se mohlo začít s klinickými testy, se musely provést série experimentů s přesně stejnou buněčnou linií: „V první řadě jsme dokázali, že dochází k terapeutickému efektu: na traumatickém poškození u rodentního modelu (na hlodavcích) jsme prokázali, že transplantované buňky se preferenčně diferencují do neuronů. Dokázali jsme, že jsou schopné vytvořit nová funkční synaptická propojení s buňkami recipienta – tedy zvířete, jemuž byly transplantovány. V rozsáhlých studiích jsme rovněž potvrdili, že tyto buňky jsou bezpečné, netvoří tumory a jsou schopné přežít v míše imunodeficientního potkana (u něhož není potřeba provádět imunosupresi) více než rok. Po této fázi bylo nutné vyvinout injekční techniku, jak dané buňky podávat do míchy velkých zvířat, jejich mícha se velikostí podobá lidské. Tyto experimenty se dělaly rovněž zde v Liběchově, zhruba před pěti lety. Vzešly z nich první publikace ukazující, jaké je optimální množství buněk, které je možné injikovat do míchy zdravých prasat, aniž bychom způsobili sekundární poškození. To byl druhý experiment – a ve třetím se pak už jen doladily injekční protokoly a koncentrace buněk, s nimiž se začalo u pacientů. Momentálně testujeme, zda je možné zvýšit počet injekcí a do jaké míry můžeme zvýšit i koncentraci vpichovaných buněk. Takže model jsme už vypracovali; víme, jak vpravovat buňky do míchy prasat; máme dobře fungující a spolehlivý injekční systém; vypracovali jsme mechanismus, jak poslat potřebné lidské buňky z USA přímo do Liběchova; zdejší tým umí buňky zpracovat a připravit k transplantaci. Uvedené série experimentů jsme dělali opakovaně.“
Jakmile se zpracují výsledky nových pokusů, bude se podle M. Maršaly opět jednat s americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) o zvýšení počtu i koncentrace buněk, které se posléze budou injikovat dalším čtyřem pacientům.
V Liběchově mě nechali nakouknout i do prostor operačního sálu, kde M. Maršala a dr. Š. Juhás právě aplikovali fetální míšní prekurzory do míchy jednoho z miniaturních prasat. Jan Motlík k tomu dodal: „Jak už to většinou ve vědě bývá, tyto experimenty daly vzniknout na první pohled vedlejšímu výsledku, s nímž se nepočítalo: Štefan s Martinem vyvinuli úplně novou metodu aplikace – tzv. subpiální metodu.“
„Subpiální je pro mnoho lidí neznámý pojem, ale kdo zná anatomii míchy, ví, že pia mater spinalis je měkká plena míšní, poslední membrána obklopující míchu,“ vysvětluje dr. Juhás a dodává, že nová metodika umožňuje podat liběchovským miniaturním prasatům pod zmíněnou membránu různé látky přibližně v objemu 100 až 200 mikrolitrů: „Dala by se využít experimentálně při vědeckých studiích, stejně jako v klinické praxi: například k podávání farmak nebo gelových podpůrných struktur či skeletů a možná i migrujících buněk, ale hlavně adenovirů, které jsou schopné nést genetickou informaci s cílem ať už zvýšit, nebo snížit expresi určitých růstových faktorů, nebo třeba pro modulaci některých patologických stavů, třeba v lokálním modelu amyotrofické laterální sklerózy u miniaturních prasat.“
Martin Maršala popisuje několikanásobné přínosy metodiky subpiálního podání virových vektorů (AAV) jakožto nosičů rozmanitých látek, genů apod.:
„V první řadě bychom chtěli tuto metodiku využít ke zvýšení počtu genů kódujících růstové faktory; předpokládáme totiž, že zvýšením růstových faktorů v poškozených axonech, tedy ve vláknech poškozených traumatem míchy, dojde k jejich prorůstání do místa poranění a k vytvoření nových synapsí s buňkami pod místem poškození. Druhá možnost je využití vektorů, které způsobují potlačení aktivity některých genů. Tato terapie bude pravděpodobně využita u geneticky podložených chorob, například u amyotrofické laterální sklerózy, kdy je možné dosáhnout potlačení aktivity patologického genu prakticky v celé míše. Třetí využití se týká značení vláken v této části míchy, která jsou infikovaná vektory, což umožňuje sledovat vývoj synapsí mezi různými motorickými systémy a míchou a mezi nervovými buňkami určitých segmentů.“
Metoda subpiální aplikace by mohla pomoci i v jednom z hlavních výzkumných cílů liběchovských vědců – v boji proti už zmíněné Huntingtonově chorobě, upozorňuje J. Motlík:„PIGMOD loni pořádal 3. konferenci věnovanou právě neurodegenerativním onemocněním a při této příležitosti měli dr. Š. Juhás i prof. M. Maršala přednášku – M. Maršala o subpiální aplikaci a budoucích možnostech jejího použití. Slyšeli to zástupci jedné důležité zahraniční firmy – přední v oblasti genové terapie – a ještě na místě konference, v Liblicích, se ustavila další velmi plodná spolupráce mezi touto firmou, naší laboratoří – centem PIGMOD a univerzitou v San Diegu. To je klasický příklad, jak náhoda ve vědě přeje připraveným, protože ve chvíli, kdy dotyčná firma, jež má unikátní vektory založené na virech AAV5, okamžitě vycítila příležitost naprosto jinak a jedinečně tyto vektory vpravovat do míchy, a nejen tam: samozřejmě věříme, že stejnou techniku bude možné použít i k subpiální aplikaci v oblasti mozku.“
Nadějné vyhlídky na lepší terapii řady neurodegenerativních a neurozánětlivých onemocnění může podpořit i jednodenní konference From oocytes to neurodegenerative diseases, která se bude konat 23. září v Liběchově a kde jako zvaní řečníci vystoupí kromě špičkových českých odborníků i vědci z Německa, Japonska a Švýcarska.

Foto: Stanislava Kyselová, Akademický bulletin
Ředitel Centra PIGMOD Jan Motlík
Klíčovou úlohu v těchto odvážných výzkumech a vědeckých plánech hraje a bude dál hrát ÚŽFG v Liběchově a jeho jedinečný biomedicínský model – miniaturní prase. Dokladem je podle prof. Motlíka mj. skutečnost, že například americká nadace CHDI Foundation, která podporuje výzkum Huntingtonovy choroby a neurodegenerativních onemocnění obecně, uzavřela s centrem PIGMOD smlouvu o spolupráci a podpoře do roku 2020: „Myslíte si, že by nám někdo slíbil podporu do roku 2020, kdyby nebyl přesvědčen, že modely, jimiž disponuje naše laboratoř a centrum PIGMOD, jsou skutečně životaschopné a jsou skutečně nezbytným krokem předcházejícím vstup do klinického testování a praxe, jak už to zde bylo popsáno pro míchu? Všichni u nás věří, že právě genová terapie bude tou metodikou, která nakonec z Huntingtonovy choroby učiní nikoli neléčitelnou, ale specificky léčitelnou chorobu.“
I tyto dalekosáhlé cíle měli liběchovští badatelé na mysli, když se v minulých letech pustili do rekonstrukce a nové výstavby. V rámci projektu ExAM(Experimental Animal Models), na nějž získali prostředky z Evropských strukturálních fondů (Regionální centra výzkumu) Operačního programu Výzkum a vývoj pro inovace, vzniklo už zmíněné centrum PIGMOD. „Byly zrekonstruovány prostory pro ustájení miniaturních prasat, zvýšila se jejich kapacita, byly klimatizovány a vybaveny veškerou technologií tak, aby splňovaly všechny podmínky pro chov unikátních zvířecích modelů. Byly vybudovány Pavilon biomedicíny a Pavilon experimentálních a chirurgických oborů, včetně moderně vybavené laboratoře společně s profesionálním operačním sálem a jeho zázemím,“ spokojeně poznamenává J. Motlík a dodává:
„Takže jsme v současné době v České republice jediné zařízení tohoto druhu, které může nabídnout naprosto excelentní podmínky pro chov transgenních miniaturních prasat jakožto jedinečného biomedicínského modelu pro studium různých onemocnění, včetně míšního traumatu nebo amyotrofické laterální sklerózy (ALS), protože skutečně věříme, že portfolio našeho centra se rozšíří tímto směrem a že i spolupráce mezi Univerzitou v San Diegu a centrem PIGMOD bude směřovat právě k ALS, protože o závažnosti tohoto onemocnění nikdo nepochybuje.“
Slova M. Maršaly dávají v tomto ohledu velkou naději: „Právě s využitím metody subpiálního podání začínáme testovat efektivitu potlačování mutovaných genů u amyotrofické laterální sklerózy. Další plán, který máme v rámci naší spolupráce s Liběchovem, je využít prasečího modelu na vytvoření regionálního modelu ALS, což znamená, že pouze určitá část míchy bude exprimovat mutovaný gen způsobující ALS, ale zvířata by měla přežívat dlouhodobě. Uvidíme, jestli se nám to povede. U potkanů se nám to podařilo: regionální subpiální podání mutovaného genu sice způsobí amyotrofickou laterální sklerózu, je ale limitovaná pouze na několik segmentů míchy. Zatím to však nikdy nebylo provedeno u velkého modelu, proto doufáme, že během letošního roku budeme mít první výsledky a pokusíme se získat i nějaký grant z ALS Foundation do Liběchova. V momentě, kdy budeme mít nějaké iniciální výsledky, bude, myslím, dost reálná šance na získání nějakého společného grantu.“
Ani tím však ambice liběchovských vědců nekončí: v dalším projektu spolupracují s kolegy zÚstavu struktury a mechaniky hornin Akademie věd ČR, kteří vyvíjejí biodegradovatelné nanomateriály na bázi kolagenu, jež se budou vpravovat do poškozených kostí a některé z nich osazovat prasečími mezenchymálními kmenovými buňkami – a následně se bude porovnávat osteointegrace, biomechanika a další parametry. Štefan Juhás upozorňuje i na výzkum doktora Tarase Ardana, na němž spolupracuje s Ústavem makromolekulární chemie AV ČR a s očními chirurgy z Fakultní nemocnice Královské Vinohrady:
„Jedná se o projekt zaměřený na terapii věkem podmíněné makulární degenerace, kdy časem dochází k poškození sítnice. Cílem je využít materiály syntetizované v ÚMCH k vytvoření podpůrné struktury – skafoldu – jako nosiče, osadit ji prasečími retinálními buňkami, implantovat do oka miniprasat a testovat všechny parametry, ať už biodegradibilitu, nebo integraci do sítnice. Samozřejmě nakonec se předpokládají i testy, zda bude nahrazený epitel funkční po stránce smyslové.“
JANA OLIVOVÁ,
Akademický bulletin
Přečtěte si také
- Vědecká rada na návštěvě v Dolních Břežanech
- Akademický sněm uvítal navýšení rozpočtu. „Je to pozitivní zpráva,“ řekla předsedkyně
- Odborníci hovořili o potenciálu a rizicích genetických modifikací
- ČR hostila 68. plenární zasedání ESFRI
- Potřebujeme ucelenou strategii pro boj se suchem, shodují se čeští odborníci
- Bez omezení benzinové a naftové dopravy nelze splnit cíle Pařížské dohody
- Kosti dokážou to, co kůže a krev. Unikátní výzkum publikoval časopis Nature
- Do Fyziologického ústavu putuje ocenění HR Excellence in Research Award
- Nová databáze DNA představuje vzorky ze starodávných lidských populací
- AV ČR vydala stanovisko k evropskému rámcovému programu Horizon Europe
Biologie a lékařské vědy
Vědecká pracoviště
- Biofyzikální ústav AV ČR
Biotechnologický ústav AV ČR
Fyziologický ústav AV ČR
Mikrobiologický ústav AV ČR
Ústav experimentální botaniky AV ČR
Ústav experimentální medicíny AV ČR
Ústav molekulární genetiky AV ČR
Ústav živočišné fyziologie a genetiky AV ČR
Cílem výzkumu je poznávání procesů v živých organismech, a to na úrovni molekul, buněk i organismů. Biofyzikální výzkum se zabývá studiem vztahu DNA – protein a vlivu faktorů životního prostředí na organismy. V oblasti molekulární genetiky a buněčné biologie jsou studovány zejména signální cesty pro spouštění reakcí a odezvy cílových genů na tyto signály; zvláštní pozornost je věnována studiu buněčných mechanismů imunitních odpovědí. Sledovány jsou rovněž genomy mikroorganismů a procesy směřující k moderním technologiím přípravy látek s definovanými biologickými účinky. V oblasti fyziologie a patofyziologie savců a člověka je výzkum zaměřen na kardiovaskulární fyziologii, neurovědy, fyziologii reprodukce a embryologii s cílem vytvořit teoretické základy preventivní medicíny. V oblasti experimentální botaniky se výzkum věnuje genetice, fyziologii a patofyziologii rostlin a moderní rostlinné biotechnologii. Sekce zahrnuje 8 vědeckých ústavů s přibližně 1930 zaměstnanci, z nichž je asi 690 vědeckých pracovníků s vysokoškolským vzděláním.